
最近几年,越来越多的神经退行性疾病,如肌萎缩侧索硬化症(ALS)、额颞叶变性(FTLD)和阿尔茨海默病(AD)等,被发现有一个共同的病理特征,即TDP-43蛋白(TAR DNA binding protein-43,TAR DNA 结合蛋白43)在细胞核中的耗竭和TDP-43蛋白通过过度磷酸化、泛素化和裂解后在细胞质中的积累。TDP-43蛋白在细胞质中的沉积会破坏核孔复合物和转运蛋白,导致核质转运障碍。TDP-43是一种全身分布的生理性蛋白质,病理状态下构成ALS泛素阳性/Tau 蛋白阴性的神经细胞内包涵体主要成分,故将此类以病理性TDP-43蛋白沉积为主的神经系统变性疾病称为单纯TDP-43病。同时也发现病理性TDP-43蛋白还见于正常衰老脑及其他神经系统变性疾病如阿尔茨海默病(AD)、帕金森病(PD)等患者脑,且病程早期即累及杏仁核,为与单纯TDP-43病相区别,将合并病理性TDP-43蛋白沉积的神经系统变性疾病称为复合TDP-43病。科睿唯安2022年度生理医学领域“引文桂冠奖(Citation Laureates)”被授予Masato Hasegawa和Virginia Man-Yee Lee,获奖原因是他们发现TDP-43是ALS和FTLD的新的病理学标志,以及TDP-43对神经退行性疾病研究的其他贡献。因“引文桂冠奖”一直是诺贝尔奖的风向标,TDP-43也由此成为神经退行性疾病领域研究的热点之一。2020年以来国家自然科学基金资助的TDP-43相关领域的研究有十余项,包括两个重大研究计划。由于TDP-43的发病机制非常复杂,本文仅简要介绍TDP-43的结构、主要生理功能、可能的发病机制以及TDP-43如何参与常见的两种神经退行性疾病ALS和AD的发展。

TDP-43蛋白(TAR DNA binding protein-43)

TDP-43是由位于1号染色体上TARDBP基因编码的43kD蛋白质,由一个N端结构域、两个RNA识别模体(RNA recognition motif,RRM)、一段核定位信号(nuclear location signal,NLS)序列、一段核输出信号(nuclear export signal,NES)序列以及一个C端结构域所构成。N端结构域与TDP-43自身相互作用有关;RRM调节与RNA和单链DNA的相互作用,参与RNA的剪接抑制等过程;NLS和NES则调控TDP-43进出细胞核;C端结构域具有朊蛋白样和液-液相分离(liquid-liquid phase separation,LLPS)特性,后者与TDP-43病理性聚集有关。生理状态下TDP-43主要位于核内,与多种DNA、RNA代谢蛋白相互作用,参与调控RNA和DNA代谢,如剪接抑制、自身调控等;发生应激时,TDP-43参与形成应激颗粒(stress granule,SG),调控细胞质内RNA代谢。

TDP-43蛋白的结构。TDP-43蛋白含有414个氨基酸,由带有核定位信号(NLS)的N端结构域、两个RNA识别基序(RRM1和RRM2)、一个核输出信号(NES)和一个具有富含谷氨酰胺/天冬酰胺(Q/N)和富含甘氨酸区域的C端结构域组成。线粒体定位基序(M1;M3;M5)也很明显。致病性突变主要位于C末端区域,其包含富甘氨酸区(GRR)并可表现出朊病毒样特性(PrLD)。

TDP-43的发病机制包括功能获得理论和功能丧失理论。根据功能获得理论,TARDBP的过度表达或突变以及TDP-43的错误定位可诱导毒性,导致神经元损伤和轴突损伤。神经病理学的特征是细胞质TDP-43包涵体的形成,伴随着细胞核中正常TDP-43的耗竭和运动神经元的进行性退化,包括突触减少、异常轴突肿胀和非神经元组织的退行性变。TDP-43的毒性与细胞核和细胞质中TDP-43含量的增加呈正相关,并表现出剂量依赖性和年龄依赖性。功能丧失理论认为,TDP-43基因的正常表达在神经元树突发育中起着重要作用,基因缺失或突变后,神经元树突发育受损。TDP-43的过度表达有效地挽救了果蝇同源基因TBPH缺乏引起的表型,这也支持功能丧失理论。因此,功能的获得和丧失都可能改善或加重TDP-43蛋白病患者的表型。目前尚不清楚TDP-43蛋白病的病因是否与TDP-43的功能障碍有关,以及TDP-43蛋白质功能的获得或丧失是否是潜在的致病机制。
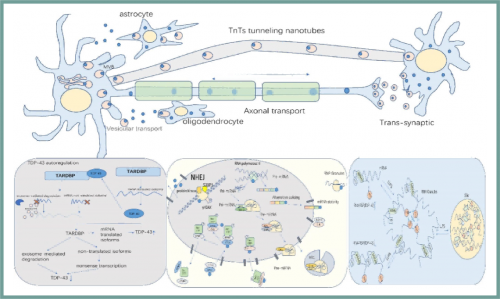
TDP-43参与细胞的正常生理活动。TDP-43参与RNA代谢的调节,包括转录抑制、编码RNA的选择性剪接以及非编码RNA(miRNA)通过直接或间接作用调节细胞周期和基因降解。TDP-43在蛋白质质量控制系统和线粒体质量控制系统中都发挥着重要作用,可以去除异常蛋白质和受损线粒体,维持正常细胞功能。TDP-43可以多种方式在细胞内和细胞间转运。


肌萎缩侧索硬化症(ALS)是一种严重的神经退行性疾病,其特征是由于运动神经元的缺失而导致的运动功能障碍。ALS有两种主要类型:散发性ALS(sALS)作为最常见的ALS形式存在于90-95%的患者中,家族性ALS仅占患者的5-10%。TDP-43基因的突变主要与fALS相关。95%以上的ALS患者可观察到TDP-43病理性异常。细胞核中TDP-43的耗竭以及细胞质中过度磷酸化、泛素化和裂解的TDP-43聚集是肌萎缩性侧索硬化的病理标志。ALS患者的TDP-43病理分布是分为5个阶段。第1阶段分布于无颗粒运动皮层、脑干运动核(颅神经XII-X、VII、V)和脊髓运动神经元;第2阶段是前额叶新皮质(额叶中回)、脑干网状结构、小脑前核和红核;第3阶段在前额叶(直回和眶回)、中央后新皮质和基底神经节(纹状体);第4阶段在颞叶、海马(内嗅皮质、下托)的前内侧部分;第5阶段位于脑干运动核(动眼神经核)、黑质、下橄榄核、小脑齿状核。TDP-43在运动和额叶皮层中的频繁错位会导致皮层过度兴奋和兴奋性神经递质减少,导致运动和认知缺陷。TDP-43的发病机制与ALS相关基因的突变有关。在ALS患者中,TDP-43通过突触转运从皮层扩散到大脑和脊髓的其他区域。与ALS相关的突变导致轴突运输紊乱,并形成TDP-43蛋白病理。TDP-43的核质转运障碍,最终会干扰其自身调节。少突胶质细胞通过单羧酸转运蛋白(MCT1)向神经元提供能量。TDP-43沉积干扰神经胶质细胞的活性,最终导致神经元丢失。TDP-43蛋白可能通过核功能缺失(loss of function)或胞质毒性功能介导细胞损伤,其参与ALS发病的病理过程主要包括线粒体损伤、内质网应激(endoplasmic reticulumstress,ER stress)、SG动力学改变和细胞降解途径异常等。
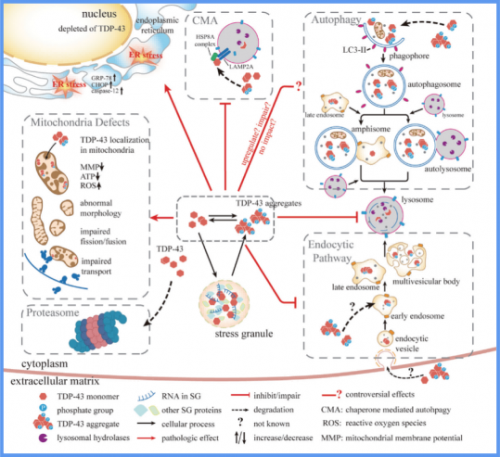
TDP-43在ALS中的部分病理机制。细胞质TDP-43通过引发线粒体损伤、内质网应激、参与应激颗粒动力学改变和作用于细胞降解途径等机制参与ALS的病理过程。TDP-43可进入线粒体,损害线粒体复合物及其氧化磷酸化功能,并导致线粒体分裂/融合动力学和转运异常。TDP-43引发内质网应激并介导细胞死亡。TDP-43聚集物的形成与应激下应激颗粒(SG)生成动力学有关,应激中SG可募集并保护细胞质内TDP-43,防止病理性聚集物的形成,SG异常解体可致TDP-43聚集。泛素-蛋白酶体系统(UPS)、自噬和内体-溶酶体途径可降解不同形式的TDP-43,在清除细胞质TDP-43上具有协同作用,但自噬也可加剧病理性TDP-43的细胞毒效应。

阿尔茨海默病(AD)是老年人出现痴呆症状的主要原因,其特征是进行性认知衰退和神经元丧失、Aβ斑块和大脑中过度磷酸化微管相关蛋白Tau的神经元内神经纤维缠结。TDP-43蛋白病被认为是AD和相关痴呆的一个重要组织病理学特征。TDP-43可能通过Aβ依赖性和Aβ非依赖性途径促进AD。TDP-43在AD中的分布可分为6个阶段:第1阶段在杏仁核;第2阶段位于内嗅皮层和下托;第3阶段位于海马齿状回和枕颞皮层;第4阶段在岛叶皮层、腹侧纹状体、基底前脑和颞下皮层;第5阶段在黑质、下橄榄核和中脑顶盖;第6阶段位于基底节和额叶中皮质。表现TDP-43、Aβ和Tau病理性联合的患者比单独Aβ和Tau的患者表现出更严重的AD痴呆。AD中TDP-43病理的位置与海马体密切相关,海马萎缩与TDP-43沉积和神经原纤维缠结NFT分期呈正相关,与年龄呈负相关。而且只有当延伸到杏仁核之外时,它才会增加临床阿尔茨海默型痴呆的可能性。TDP-43与阿尔茨海默病(AD)中的海马萎缩有关,但是否有其他因素影响这种关联尚不清楚。
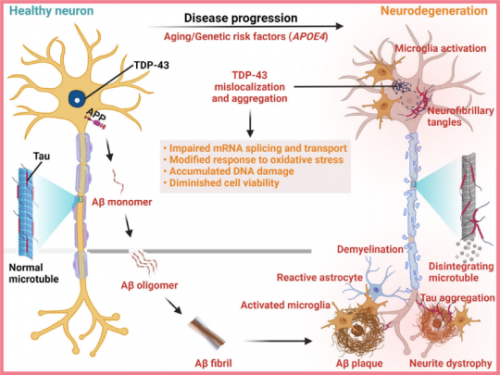
TDP-43参与阿尔茨海默病进展。TDP-43在细胞质中合成,并保留从细胞质穿梭到其主要驻留的细胞核的能力,以执行其生理功能,如RNA剪接。在AD的发展过程中,致病事件导致TDP-43从细胞核中耗尽,TDP-43在细胞质中定位错误,并形成不溶性TDP-43聚集体。病理性TDP-43引起的神经变性可由生理功能丧失和毒性功能增加的潜在组合引起。

TDP-43蛋白病在一系列神经退行性疾病中被发现,包括ALS、FTLD、AD、PD、HD、HS等。因此,TDP-43蛋白质病可能是神经退变性疾病中神经元损伤的病理机制之一。目前的研究发现,生理性TDP-43相当复杂,参与多种生理反应,包括自我调节、RNA生物生成、DNA修复、核糖体蛋白翻译、轴突运输、囊泡运输、蛋白质和线粒体的质量控制系统以及应激颗粒的稳态。在正常情况下,TDP-43通过自身调节参与细胞核内各种RNA的形成和剪接。核孔复合体是TDP-43从细胞核进入细胞质进行正常功能所必需的细胞结构。核孔蛋白和转运因子的分离或错位受疾病相关的突变体TDP-43聚集的影响。它干扰核蛋白和RNA的核质转运。细胞的正常生理功能受到破坏。核孔复合体的结构或功能障碍是神经退行性疾病的常见机制。TDP-43参与应激颗粒的形成,从应激环境中分离RNA和参与转录和翻译的重要蛋白质。总之,TDP-43在细胞核、细胞质和细胞中发挥着多种生理功能。随着对TDP-43的日益了解,TDP-43可作为神经退行性疾病诊断的生物标志物,或作为神经退变性疾病治疗的靶点。目前所发现的TDP-43突变还有许多尚未在细胞和动物模型中进行毒性机制的探索和验证,因此未来更广泛地研究有利于具体化、精准化地理解不同病理性TDP-43的病理机制,为寻找潜在的个体化治疗靶点和精准治疗策略提供帮助。
参考文献:
1.Liao, YZ., Ma, J. & Dou, JZ. The Role of TDP-43 in Neurodegenerative Disease. Mol Neurobiol 59, 4223–4241 (2022).
2.Meneses, A., Koga, S., O’Leary, J. et al. TDP-43 Pathology in Alzheimer’s Disease. Mol Neurodegeneration 16, 84 (2021).
3.Hayes, L.R., Kalab, P. Emerging Therapies and Novel Targets for TDP-43 Proteinopathy in ALS/FTD. Neurotherapeutics 19, 1061–1084 (2022).
4. 黄茂鑫,廉宏想,王俊岭.TDP-43参与肌萎缩侧索硬化症的病理机制研究进展[J].临床与病理杂志,2021,41(07):1665-1673.
文案 | 灵犀
排版 | 周琦
审核 | Jane 刘泽鹏

(责任编辑:华康)